PDF enthält Tabellen und/oder Abbildungen
Identifikation neuer antiarrhythmischer Ansatzpunkte: Sacubitril übt direkte antiarrhythmische Effekte über NPR-C aus
Dr. Manuel Vogel und Prof. Dr. Thomas Fischer, Würzburg
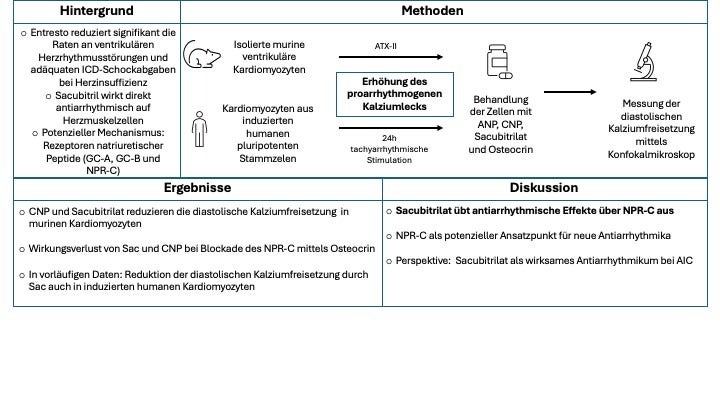
Hintergrund
Die Kombination aus Sacubitril und Valsartan (Entresto) stellt eine essenzielle Therapiesäule in der medikamentösen Behandlung von Patient:innen mit Herzinsuffizienz dar, da es die Sterblichkeit senkt und die Lebensqualität verbessert. Darüber hinaus konnte in früheren Studien gezeigt werden, dass auch die Häufigkeit von ventrikulären Herzrhythmusstörungen sowie die Anzahl an Schockabgaben bei Patient:innen mit implantierten Defibrillatoren reduziert wurden. Bisherige experimentelle Arbeiten deuten darauf hin, dass Sacubitril (Sac) im Gegensatz zu Valsartan einen direkten antiarrhythmischen Effekt auf Herzmuskelzellen ausübt, indem es die arrhythmogene Kalziumfreisetzung in der Diastole reduziert.
Ziel
Über welchen zellulären Mechanismus Sac auf die Herzmuskelzelle wirkt, ist jedoch noch unklar. Ziel der Studie war es, mögliche zelluläre Signalwege zu identifizieren. Da Sac als Inhibitor von Neprilysin wirkt, das für den Abbau der natriuretischen Peptide ANP, BNP und CNP (atrial/brain/c-type natriuretic peptide) verantwortlich ist, lag ein besonderes Augenmerk auf den natriuretischen Peptiden und ihren Rezeptoren: Guanylatzyclase A (GC-A, Bindung von ANP und BNP) und B (GC-B, Bindung von CNP) sowie Natriuretic Peptide Receptor C (NPR-C, alle natriuretischen Peptide).
Methoden
Ventrikuläre Kardiomyozyten von Wildtyp-Mäusen wurden isoliert und mit ATX-II (Seeanemonen Toxin II) behandelt, welches die zelluläre Ionenhomöostase durch Erhöhung des späten Natrium-Einstroms destabilisiert und konsekutiv zu vermehrten diastolischen Kalzium Freisetzungen (sog. Kalzium Sparks, CaSp) führt. Pathologische Veränderungen bei Herzinsuffizienz werden so nachgeahmt. CaSp gelten als wichtiges zelluläres Korrelat einer elektrischen Instabilität und wurden in dieser Studie mittels hochauflösender Mikroskopie (Konfokalmikroskopie) untersucht. Die Zellen wurden dann mit Sac, ANP oder CNP behandelt, um zu überprüfen, ob durch diese Substanzen eine Reduktion der CaSp-Frequenz (CaSpF) erzielt werden kann. Epifluoreszenzmikroskopische Messungen wurden durchgeführt, um die Menge des im sarkoplasmatischen Retikulum (SR) gespeicherten Kalziums und die systolische Kalziumfreisetzung zu quantifizieren. Außerdem wurde die Wirkung der Substanzen auf den zellulären Botenstoff cGMP untersucht, der bei Aktivierung von GC-A und GC-B – nicht aber von NPR-C - gebildet wird. Zur Überprüfung der translationalen Relevanz erfolgten zusätzliche Untersuchungen an Kardiomyozyten aus induzierten humanen pluripotenten Stammzellen (iPSC-CM). Durch tachyarrhythmische Stimulation (2Hz, 40% Zykluslängenvariabilität) der Zellen über 24 Stunden im Vorfeld der Messungen wurde eine Arrhythmie-induzierte Kardiomyopathie (AIC) simuliert.
Ergebnisse
Die Behandlung mit ATX-II erhöhte die CaSpF signifikant. Die Inkubation mit Sac sowie CNP führte jeweils zu einer signifikanten Reduktion der CaSpF, wohingegen ANP keinen signifikanten Effekt auf die CaSpF hatte. Um herauszufinden, über welchen Rezeptor dieser Effekt vermittelt wird, wurde NPR-C mit Osteocrin blockiert. Es zeigte sich, dass sowohl die Wirkung von Sac als auch die von CNP auf die CaSpF bei Co-Inkubation mit Osteocrin aufgehoben wurde. Dies deutet darauf hin, dass die antiarrhythmische Wirkung von Sac über den NPR-C-Rezeptor vermittelt wird. Sac beeinflusste weder die systolischen Kalziumtransienten noch die Gesamtmenge des im SR gespeicherten Kalziums und hatte im Gegensatz zu CNP keinen signifikanten Einfluss auf die cGMP-Spiegel, was für einen NPR-C-abhängigen und CNP-unabhängigen Signalweg spricht. Vorläufige Ergebnisse zeigen, dass die tachyarrhythmische Stimulation bei iPSC-CM zu einer signifikanten Steigerung der CaSpF führte. Die Behandlung mit Sac senkte die erhöhte CaSpF wiederum ab, wohingegen eine gleichzeitige Inkubation mit Osteocrin diesen Effekt aufhob.
Schlussfolgerung/Fazit
Diese Ergebnisse legen einen neuen antiarrhythmischen Wirkmechanismus von Sac über NPR-C nahe. Dieser Signalweg ist bezüglich seiner antiarrhythmischen Wirkung weitestgehend unerforscht und könnte zukünftig als Ansatzpunkt für die Entwicklung neuer Antiarrhythmika dienen. Die vorläufigen Daten aus bei iPSC-CM legen nahe, dass Sac (bzw. NPR-C-Agonisten) potenziell als Antiarrhythmikum bei AIC wirksam sein könnten.