In der Late-Breaking-Session der diesjährigen Jahrestagung der Deutschen Gesellschaft für Kardiologie (DGK) stellte Dr. med. Edvard Liljedahl Sandberg (Sørlandet Hospital, Norwegen) eine Selbstscreening-Methode für die Detektion von Vorhofflimmern vor. Obwohl die „Number needed to screen“ durchaus überzeugend ist, wies Prof. Dr. med. David Duncker auf wichtige Limitationen der vorgestellten Screening-Methode mittels Pflaster hin. 1,2
Vorhofflimmern: Wie alltagstauglich ist die innovative Selbstscreening-Methode aus Norwegen?
Von Dr. Annabelle Eckert
14.04.2023
Was sagen die ESC-Leitlinien zum Screening bei Vorhofflimmern?
Die ESC-Leitlinien empfehlen ein Screening von Personen mit einem Risiko für das Auftreten von Vorhofflimmern. In den ESC Pocket Guidelines (Version 2020) heißt es hierzu: „Zu den häufig verwendeten AF-Screening-Typen und -Strategien gehört ein opportunistisches oder systematisches Screening von Personen ab einem bestimmten Alter (in der Regel > 65 Jahre) oder mit anderen Merkmalen, die auf ein erhöhtes Schlaganfallrisiko hindeuten.“ Aktuell muss noch geklärt werden, welche Screening-Methoden sich hierfür am besten eignen und im Alltag auch umsetzbar sind. Ziel zukünftiger Selbstscreening-Methoden sollte es sein, Patientinnen und Patienten mit klinisch relevantem Vorhofflimmern zu detektieren. Auf der 89. Jahrestagung der DGK entfachte diese Thematik eine wissenschaftliche Debatte.1,3,4
Kontinuierliches Rhythmus-Monitoring per App
Edvard Liljedahl Sandberg stellte dem Auditorium die wichtigsten Daten aus seiner Publikation zum kontinuierlichen Selbstscreening auf Vorhofflimmern mit einem Patch-EKG-Gerät (ECG247 Smart Heart Sensor) vor. Sandberg verwies in seinem Vortrag auf die ESC-Empfehlung zum Screening auf Vorhofflimmern. Bisher scheiterte die Umsetzung dieser Empfehlung an der alltäglichen Durchführbarkeit. Sandberg und sein Forschungsteam hatten sich zum Ziel gesetzt, ein im Patientenalltag umsetzbares Screening-Konzept zu entwickeln. In der Late-Breaking-Session der diesjährigen Jahrestagung der DGK präsentierte er einen EKG-Sensor, den Patientinnen und Patienten eigenständig zu Hause anbringen können. Die Überwachung der so erhobenen Herzrhythmus-Daten sei mühelos per App möglich, so Sandberg.1,3
Die Zukunft der personalisierten Medizin ist digital
In die Studie eingeschlossen wurden insgesamt 2118 Personen mit einem Alter von ≥ 65 Jahren und einem CHA2DS2-VASc-Risikoscore von ≥ 2 Punkten, bei denen bis zum Zeitpunkt des Studieneinschlusses noch kein Vorhofflimmern diagnostiziert worden war. Die Rekrutierung erfolgte hauptsächlich über Social-Media-Kanäle. Die Studienteilnehmer und -teilnehmerinnen stammten aus der norwegischen Allgemeinbevölkerung – dies war eines der Einschlusskriterien gewesen. Der Einstiegstest zur Prüfung der Einschlusskriterien erfolgte digital. 1
Anruf bei Arrhythmie
Das Rhythmus-Monitoring erfolgte durch ein Pflaster-EKG-Gerät (ECG247 Smart Heart Sensor). Dieses hatten die Studienteilnehmenden zuvor kostenfrei per Post erhalten. Sandberg betonte, dass die Überwachung vollständig digital und kontinuierlich verlief. Die Studienteilnehmerinnen und -teilnehmer hatten die Möglichkeit, dem Forschungsteam Selbstauskünfte über klinische Merkmale und Benutzerfreundlichkeit online mitzuteilen. Die Rückmeldung über die patienteneigenen Ergebnisse erfolgte ebenfalls digital. Nach Beendigung des Tests wurde der wiederverwendbare Anteil des Pflaster-EKG-Geräts postalisch an das Forschungsteam zurückgeschickt. Im Fall einer Arrhythmie wurden die Studienteilnehmenden umgehend telefonisch kontaktiert. 1
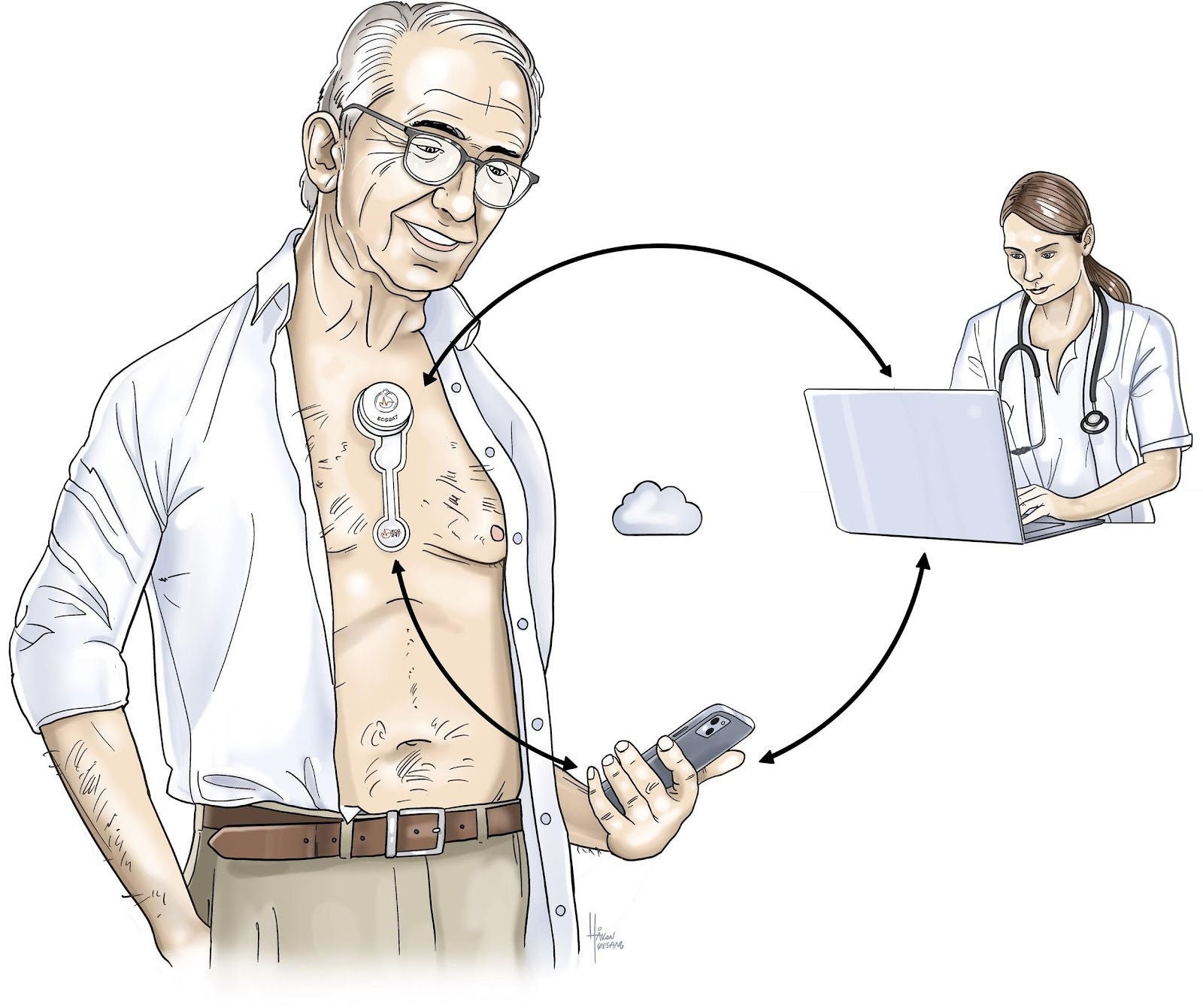 Abbildung 1: Darstellung des Selbstscreening-Verfahrens auf Vorhofflimmern (ECG247 Smart Heart Sensor self-screening device). 2 | Bildquelle: Håkon Jøssang
Abbildung 1: Darstellung des Selbstscreening-Verfahrens auf Vorhofflimmern (ECG247 Smart Heart Sensor self-screening device). 2 | Bildquelle: Håkon Jøssang
Überzeugende „Number needed to screen“
Die Studienteilnehmer und -teilnehmerinnen hatten einen mittleren CHA2DS2-VASc-Risikoscore von 2,6 (0,9). Das Durchschnittsalter lag bei 70,1 Jahren. Der Großteil der Studienteilnehmenden (87,3 %) schloss den EKG-Selbsttest eigenständig ab. Lediglich 2,5 % schafften es nicht, den EKG-Selbsttest zu starten. 10,2 % unternahmen erst gar nicht den Versuch, den Test in Gang zu setzen. Die durchschnittliche EKG-Überwachungszeit lag bei 153 Stunden. Vorhofflimmern konnte bei 2,2 % der teilnehmenden Personen mittels Selbstscreening detektiert werden. Die geringe Anzahl der notwendigen Screeningvorgänge (Number needed to screen: 45) beeindruckte selbst Prof. Dr. med. Duncker, der die Studienergebnisse im Anschluss an Sandbergs Vortrag unter anderen Gesichtspunkten abhandelte. 1,3
Wichtige Limitationen des Selbstscreening-Verfahrens auf Vorhofflimmern
In seinem Vortrag machte Duncker auf die Limitationen dieser innovativen Selbstscreening-Methode aufmerksam: Durch das Pflaster-EKG-Gerät würde jegliche Vorhofflimmer-Episode, unabhängig von ihrer klinischen Relevanz dokumentiert werden. Dabei sei es das Ziel, Patientinnen und Patienten mit klinisch relevantem Vorhofflimmern zu detektieren, um genau diese Bevölkerungsgruppe vor einem Schlaganfall zu bewahren.
Da die aktuelle Version der von Sandberg vorgestellten Selbstscreening-Methode keinen Unterschied zwischen klinisch relevantem Vorhofflimmern und asymptomatischem Vorhofflimmern machen würde, stellt sich folglich die Frage nach dem therapeutischen Nutzen einer oralen Antikoagulation für die letztere Gruppe. Duncker fügte hinzu, dass die Einschlusskriterien und das Rekrutierungsverfahren überdacht werden sollten. Die Rekrutierung via Social Media könnte zu einem Ausschluss von Personen führen, die keinen Zugang zum Internet haben oder nicht technikaffin sind. Auch sei zu beachten, dass ein gewisser Anteil an Personen mit einem möglichen, bis dato unbekannten Schlaganfallrisiko aufgrund des Einstiegstests nicht in die Studie eingeschlossen würden. In der von Sandberg vorgestellten Studie wären dies immerhin 13 % gewesen.
Duncker verwies im Zuge dessen auf die STROKESTOP-Studie. Aus dieser Studie würden die gesundheitlichen Folgen des Ausschlusses einer bestimmter Personengruppe im Rahmen der Onboarding-Phase ersichtlich werden. Duncker schlug eine Überarbeitung der Einschlusskriterien anhand des EHRA-Praxisleitfadens bei der Anwendung digitaler Geräte zur Erkennung und Behandlung von Herzrhythmusstörungen vor. Im EHRA-Praxisleitfaden würden bei jüngeren Patienten (< 75 Jahren) Komorbiditäten wie Schlafapnoe, chronische Nierenerkrankung, Herzinsuffizienz, koronare Herzkrankheit, chronisch obstruktive Lungenerkrankung, Diabetes mellitus, Adipositas oder auch ein Myokardinfarkt in der Vergangenheit ebenso eine wichtige Rolle hinsichtlich des Schlaganfallrisikos spielen. 2,5,6
Fazit
- Das vorgestellte Selbstscreening-Verfahren besitzt eine exzellente „Number needed to screen“
- Die technische Voraussetzung für ein Selbstscreening auf jegliches Vorhofflimmern ist per EKG-Patch und App möglich
- Das Selbstscreening-Verfahren kann aktuell nicht zwischen asymptomatischem und klinisch relevantem Vorhofflimmern unterscheiden
- Möglicher Bias durch Ausschluss einer bestimmten Bevölkerungsgruppe mit unbekanntem Schlaganfallrisiko
- Überarbeitung der Einschlusskriterien und des Rekrutierungsverfahrens notwendig
- Eine größere Anzahl an Komorbiditäten sollte in die Einschlusskriterien miteinbezogen werden
Referenzen
- Sandberg, EL. Fully digital self-screening for atrial fibrillation with patch electrocardiogram. Sprecher, Hotline Late Breaking Clinical Trials II, Vorsitz: Birkenmeyer R, Meyer C, 89. Jahrestagung der Deutschen Gesellschaft für Kardiologie (DGK), 08:30 Uhr, 14. April 2023.
- Duncker, David. Fully digital self-screening for atrial fibrillation with patch electrocardiogram. Diskutant, Hotline Late Breaking Clinical Trials II, Vorsitz: Birkenmeyer R, Meyer C, 89. Jahrestagung der Deutschen Gesellschaft für Kardiologie (DGK), 08:37 Uhr, 14. April 2023.
- Sandberg EL Halvorsen S, Berge T, Grimsmo J, Atar D, Fensli R, Grenne BL, Jortveit J (2023). Fully digital self-screening for atrial fibrillation with patch electrocardiogram. Europace. 2023 Mar 22:euad075.
- https://leitlinien.dgk.org/files/21_2021_pocket_leitlinie_vorhofflimmern_komprimiert.pdf
- Svennberg E. et al. (2022). How to use digital devices to detect and manage arrhythmias: an EHRA practical guide. Europace. 2022 Jul 15;24(6):979-1005.
- Svennberg E. et al. (2021). Clinical outcomes in systematic screening for atrial fibrillation (STROKESTOP): a multicentre, parallel group, unmasked, randomised controlled trial. The Lancet. Vol. 398, Issue 10310, 1498-1506, October 23, 2021.
